| Jul 09, 2012 |
Neue Einsichten, wie Zuckermolek�le mit Proteinen wechselwirken
|
|
(Nanowerk News) Zuckermoleküle spielen eine bedeutende Rolle in molekular-biologischen Prozessen der Signalübertragung und des gegenseitigen Erkennens von Zellen. Wie nun Forschende der Universität Basel zeigen, können Zuckermoleküle als vorgeformte Cluster von Wassermolekülen verstanden werden. Damit eröffnen sich neue Perspektiven, zuckerähnliche Strukturen als Medikamente einzusetzen. Die Studie wurde vom Fachmagazin Angewandte Chemie als «Very Important Paper» veröffentlicht ("Sialyl Lewisx: A “Pre-Organized Water Oligomer”?").
|
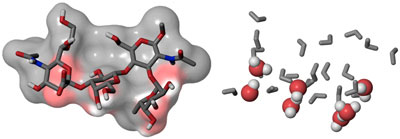 |
| Das Zuckermolekül sLex (links) mimt die Wassermoleküle (rechts), die das Selectin umgeben. Als vorgeformter Wassercluster kann sLex deshalb analog zu den Wassermolekülen spezifische Wechselwirkungen mit dem Zielprotein ausbilden.
|
|
Das Zuckermolekül sLex (links) mimt die Wassermoleküle (rechts), die das Selectin umgeben. Als vorgeformter Wassercluster kann sLex deshalb analog zu den Wassermolekülen spezifische Wechselwirkungen mit dem Zielprotein ausbilden.Selectine sind Proteine, die mit Zuckern wechselwirken und als therapeutische Zielmoleküle zunehmend Beachtung finden. Zugeschrieben wird ihnen eine Schlüsselrolle bei der Entstehung von Entzündungen, wie sie z.B. bei Asthma, Schuppenflechten oder rheumatoider Arthritis auftreten. Die molekulare Wechselwirkung zwischen Selectinen und ihren Bindungspartnern wird durch den Zucker Sialyl Lewisx (sLex) vermittelt. Ein therapeutischer Ansatz besteht darin, diese Wechselwirkung zu unterbinden. Auf der Suche nach potenten Selectin-Blockern wurde sLex deshalb als Leitstruktur verwendet. Die treibenden Kräfte hinter den Wechselwirkungen zwischen Selectinen und sLex wurden bisher aber nur unvollständig aufgeklärt.
|
|
Die Arbeitsgruppe von Beat Ernst, Professor für Molekulare Pharmazie an der Universität Basel, konnte nun nachweisen, dass sich sLex wie eine Ballung ("Cluster") von Wassermolekülen verhält. Darin sind die Wassermoleküle für die Bindung an das Selectin geforderte Geometrie angeordnet. Dieser vorgeformte Wassercluster ermöglicht die Ausbildung von spezifischen Wechselwirkungen mit den Selectinen.
|
|
Aufgrund der Ähnlichkeit der Leitstruktur sLex mit dem vorgeformten Wassercluster erwies sich deren Weiterentwicklung zu einem therapeutischen Wirkstoff gegen Entzündungskrankheiten als äusserst schwierig. In ihrer Publikation schlagen die Forschenden nun eine neue Strategie vor: Während derjenige Teil von sLex, der den Wassercluster mimt, übernommen wird, sollen diejenigen Teile, die nicht im direkten Kontakt zum Selectin stehen, durch wasserabweisende Strukturen ersetzt werden.
|
|
Mit ihrer Arbeit haben Prof. Ernst und sein Team vom Departement für Pharmazeutische Wissenschaften einen wichtigen Beitrag zur Erschliessung von Selectinen als therapeutische Zielmoleküle geleistet. Ein erfolgreiches Beispiel aus ihrer Selectin-Forschung, der Wirkstoff GMI-1070, befindet sich zurzeit in Phase II der klinischen Entwicklung
|

